4月27日,从国家医疗器械技术审评中心获悉,依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告),创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行审查,拟同意以下申请项目进入特别审查程序,现予以公示。

详情如下:
1、广州市金圻睿生物科技有限责任公司
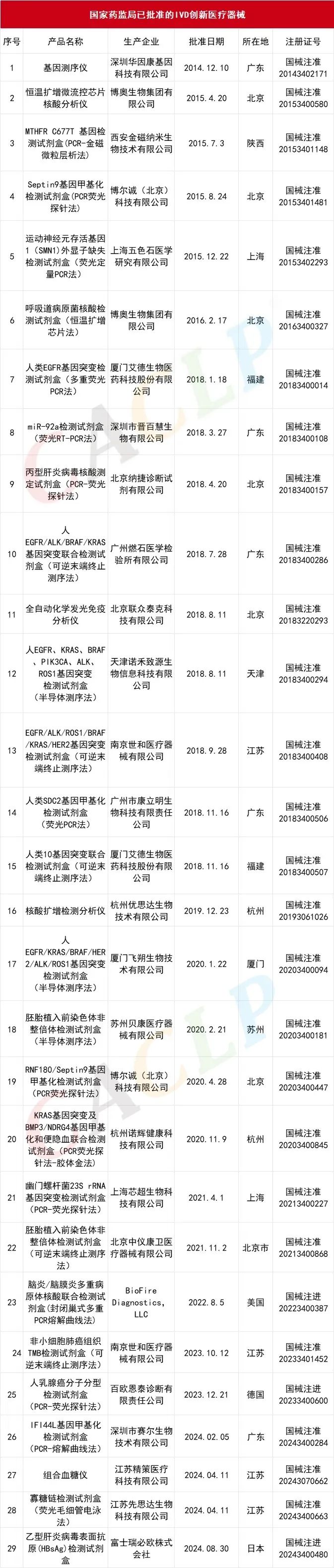
经CACLP统计,截至目前国家药监局共批准293款创新医疗器械上市,其中IVD创新体外诊断产品29个。
【来源:国家药品监督管理局、CACLP。】
4月27日,从国家医疗器械技术审评中心获悉,依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告),创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行审查,拟同意以下申请项目进入特别审查程序,现予以公示。

详情如下:
1、广州市金圻睿生物科技有限责任公司
经CACLP统计,截至目前国家药监局共批准293款创新医疗器械上市,其中IVD创新体外诊断产品29个。
